Las plantas dependen de su capacidad de percibir la luz para sobrevivir. Pero, a diferencia de los animales, las plantas no tienen ojos llenos de fotorreceptores para captar y transmitir los mensajes de los estímulos visuales. En cambio, las plantas están recubiertas de una red de fotorreceptores que detectan diferentes longitudes de onda de la luz, los que les permite regular sus ciclos de vida y ajustarse a las condiciones ambientales.
Científicos del Instituto Van Andel y de la Universidad de Washington han logrado determinar la estructura molecular de uno de estos fotorreceptores vitales, una proteína conocida como PhyB, revelando una estructura totalmente diferente a la conocida hasta ahora. Los hallazgos. publicados en la revista científica Nature, pueden tener importantes implicaciones para las prácticas agrícolas y para la denominada como bioingeniería “verde”.
“Fotorreceptores, como el PhyB, ayudan a las plantas a percibir el mundo que las rodea y a responder a él, influyendo en muchos procesos vitales como la evitación de la sombra, la germinación de las semillas, la determinación del momento de floración y el desarrollo de cloroplastos, que convierten la luz en energía utilizable. Nuestra nueva estructura arroja luz sobre el funcionamiento de PhyB y tiene el potencial para el desarrollo de una serie de aplicaciones en la agricultura, las energías renovables o incluso en la obtención de imágenes celulares”, explica el doctor Huilin Li, profesor del Instituto Van Andel, y coautor del estudio.

El potencial del fitocromo B de las plantas
Muchos organismos utilizan una serie de fotorreceptores que les ayudan a adaptar su crecimiento/movilidad y desarrollo a su entorno de luz. Una clase destacada son los fotorreceptores Phy, que son universales entre las plantas y están ampliamente dispersos en los reinos fúngicos y bacterianos.
Por tanto, muchos aspectos de la fotopercepción de las plantas están mediados por la familia del fitocromo (Phy), fotorreceptores que contienen bilina y que se convierten reversiblemente entre los conformadores inactivos Pr y activos Pfr. Es decir, los fotorreceptores Phy se unen autocatalíticamente a un grupo prostético de bilina para permitir la sensación de luz roja y roja lejana mediante la fotointerconversión Pr-Pfr y la reversión térmica de Pfr a Pr.
En las plantas, este intercambio Pr-Pfr proporciona un fotointerruptor maestro para cuantificar la tasa de fluencia de la luz, la duración y la calidad espectral, lo que a su vez permite responder a los ciclos día-noche, al fotoperiodo y a la competencia entre vecinos. Además, algunos fotorreceptores Phy de las plantas detectan la temperatura a través de la reversión térmica, cuya tasa se acelera fuertemente a medida que aumenta la temperatura.
Aunque se ha avanzado considerablemente en el conocimiento de los fotorreceptores procarióticos, todavía no sabemos cómo señalan los fotorreceptores vegetales, a pesar de su importancia en numerosos procesos agrícolas, que van desde la germinación de las semillas y el desarrollo de los cloroplastos hasta la evitación de la sombra y el tiempo de floración.
Por tanto, entender la forma del PhyB es importante porque su estructura influye directamente en la que este interactúa con otras moléculas para comunicar cambios en las condiciones de luz y ayuda a las plantas a adaptarse impulsado por cambios en la expresión genética.
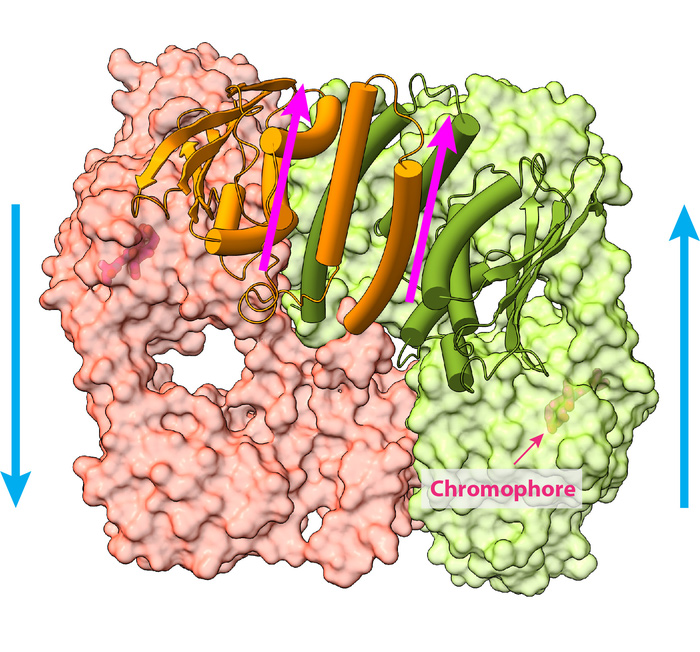
Las investigaciones anteriores sobre la PhyB sólo proporcionaban una imagen trucada en lugar de una representación detallada de toda la molécula. Para determinar una imagen de casi resolución atómica, Li y el coautor del estudio, el doctor Richard D Vierstra de la Universidad de Washington, recurrieron a una de las plantas más estudiadas de la Tierra: una humilde hierba llamada Arabidopsis thaliana. Esta pequeña planta con flores es un modelo ideal para la investigación porque se reproduce rápidamente, es pequeña y es fácil de cultivar.
Usando el microscopio crio-electrónico de alta potencia del Instituto Van Andel, el equipo de investigación tomó casi un millón de imágenes de partículas PhyB conectadas con su cromóforo natural, una moléculas que absorbe un determinado color de la luz. Luego redujeron las imágenes a 155.000, las cuales utilizaron para construir la visualización completa de la estructura del PhyB a un nivel casi atómico de 3,3 Ångstrom.
Su trabajo reveló una gran sorpresa: en lugar de la estructura paralela descrita por estudios anteriores, encontraron una complicada estructura 3D con secciones paralelas y antiparalelas. Los resultados sugieren que PhyB puede amplificar pequeños cambios en las moléculas cromóforas que detectan la luz y cambiar drásticamente su forma en respuesta, un movimiento que comunica la disponibilidad de luz a la planta.
Este descubrimiento es el resultado de más de una década de colaboración entre Li y Vierstra, y revoluciona lo que sabemos sobre el PhyB y los fitocromos, la familia de receptores a la que pertenece el PhyB. Hasta ahora se creía que el PhyB y otros fitocromos eran probablemente similares a los utilizados por los organismos unicelulares, como ciertas bacterias. Este último descubrimiento echa por tierra esa teoría y sienta las bases para seguir estudiando los intrincados detalles de los fitocromos y el PhyB.

Imagen portada: Pixabay. Resto: Unsplash



