El deterioro de la visión representa una de las discapacidades más frecuentes en el mundo industrializado, y existen muy pocas opciones de tratamiento. Muchas de las enfermedades relacionadas con la vista se caracterizan por la pérdida progresiva de células fotorreceptoras, las cuales carecen de la capacidad de regenerarse. Es decir, cuando estas mueren, no son capaces de regenerarse en ningún mamífero, incluidos los humanos. Es por ello, que el trasplante de células fotorreceptoras es una prometedora intervención que en el futuro podría ayudar a recuperar la visión en personas con estas enfermedades degenerativas de la vista.
Un equipo de investigadores, dirigido por el profesor Marius Ader jefe del Centro de Terapias Regenerativas de la Universidad Técnica de Dresde, acaba de presentar un avance preclínico donde desarrolla un robusto método para producir un elevado número de células fotorreceptoras humanas. Los investigadores han demostrado cómo estos fotorreceptores humanos pueden incorporarse en masa a retinas de ratón parcialmente degeneradas, desarrollando características de los fotorreceptores normales y pudiendo detectar la luz del día en ratones con la visión dañada.
Estos resultados, publicados recientemente en the Journal of Clinical Investigations (JCI), representa todo un paso adelante en el hecho de poder conseguir trasplantes de fotorreceptores a los pacientes con problemas en la vista. “Que sepamos, es la primera vez que alguien logra una integración masiva de fotorreceptores trasplantados en la retina”, afirma el profesor Marius Ader.
Trasplante de células fotorreceptoras
Las terapias de reemplazo celular son una opción atractiva para las enfermedades de la retina, ya que el ojo es un órgano autónomo y parcialmente inmune, lo que minimiza el riesgo de migración y rechazo celular no deseado.
Además, el ojo es fácilmente accesible y se controla fácilmente. La región foveal rica en conos, que es extremadamente importante para la visión humana ya que facilita tareas como la lectura, el reconocimiento facial y la conducción, es relativamente pequeña, lo que reduce la cantidad de células donantes necesarias. Dentro de la fóvea, solo hay aproximadamente 200.000 conos, una serie de células que se producen fácilmente con la tecnología organoide actual.
En esta nueva investigación los científicos se propusieron el trasplantar fotorreceptores humanos generadas a través organoides de retina ricos en conos, con el objetivo de investigar cómo maduran estos conos trasplantados y cómo es la interacción entre el donante y el huésped a lo largo del tiempo del transplante.
Múltiples factores en juego
Para aumentar masivamente el número de fotorreceptores incorporados, los científicos tuvieron que optimizar múltiples factores críticos, siendo la edad de los fotorreceptores un factor crítico: “Hemos conseguido encontrar lo que parece ser un estadio perfecto para transmitir los fotorreceptores a la retina. Si lo hacemos con fotorreceptores más jóvenes o más viejos, observamos un fuerte descenso en la tasa de incorporación”, detalla Ader.
El equipo también descubrió que la integración en la retina también necesita más tiempo. Las células fotorreceptoras necesitarán un tiempo de hasta seis meses para establecer interacciones y construir una red adecuada con las células restantes de la retina del ratón.
Finalmente, la interacción con las células restantes, no dañadas, de la retina del ratón también resultó ser un factor clave. “Alrededor del 30% de las células de la retina son otras células que apoyan el trabajo de los fotorreceptores. En nuestro caso, vimos claramente que la interacción de las células trasplantadas con las células de la retina del huésped era crucial para el éxito de la incorporación y de la maduración. Algunas de estas células restantes proporcionan un andamiaje a los nuevos fotorreceptores, ayudándoles a organizarse correctamente”, explica el profesor Ader.
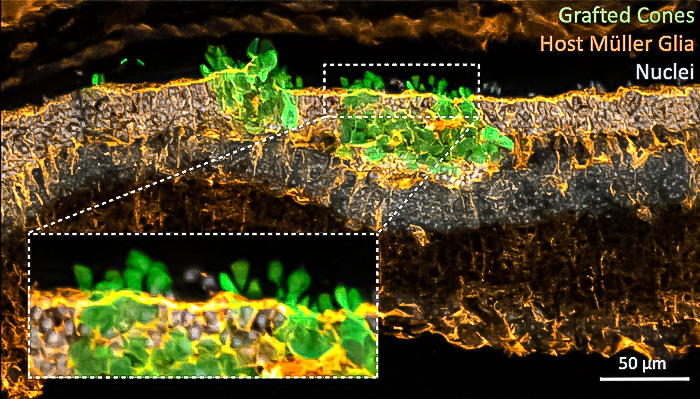
Restaurando la percepción de la luz del día
El estudio se centró en ratones con retinas parcialmente degeneradas que carecían de uno de los dos tipos de fotorreceptores. Los ratones solo tenían dañados los conos, que son los responsables de la visión diurna, una situación similar a las varias enfermedades que provocan ceguera en humanos.
El método se difiere de estudios anteriores porque las células restantes de la retina no estaban dañadas. Hasta ahora, la mayoría de los intentos de trasplante se dirigían a modelos de enfermedades de ceguera en fase muy avanzada, caracterizadas por la degeneración de todos los fotorreceptores.
El equipó empleó diversas técnicas para validar a fondo la maduración y la función de los fotorreceptores trasplantados. Pudieron demostrar que los nuevos fotorreceptores no sólo adoptan las características fisiológicas de los fotorreceptores normales, sino que funcionan correctamente proporcionando señales a las células nerviosas de la retina.
¿Un nuevo paradigma?
“Realmente estamos entusiasmados con lo bien que se incorporaron los fotorreceptores humanos gracias al apoyo de las células de la retina del ratón anfitrión. Podría ser útil replantear futuros enfoques de trasplante. Tal vez la intervención en un momento en que la retina del paciente todavía es capaz de interactuar de forma significativa con el trasplante de fotorreceptores podría producir un resultado beneficioso también en los seres humanos”, concluye el profesor Ader.
Imagen de portada: Unsplash