Investigadores rusos logran desarrollar un nuevo tipo de proteínas fluorescentes que se pueden controlar con luz naranja y verde, y que van a permitir el estudio de células vivas sin daño alguno.
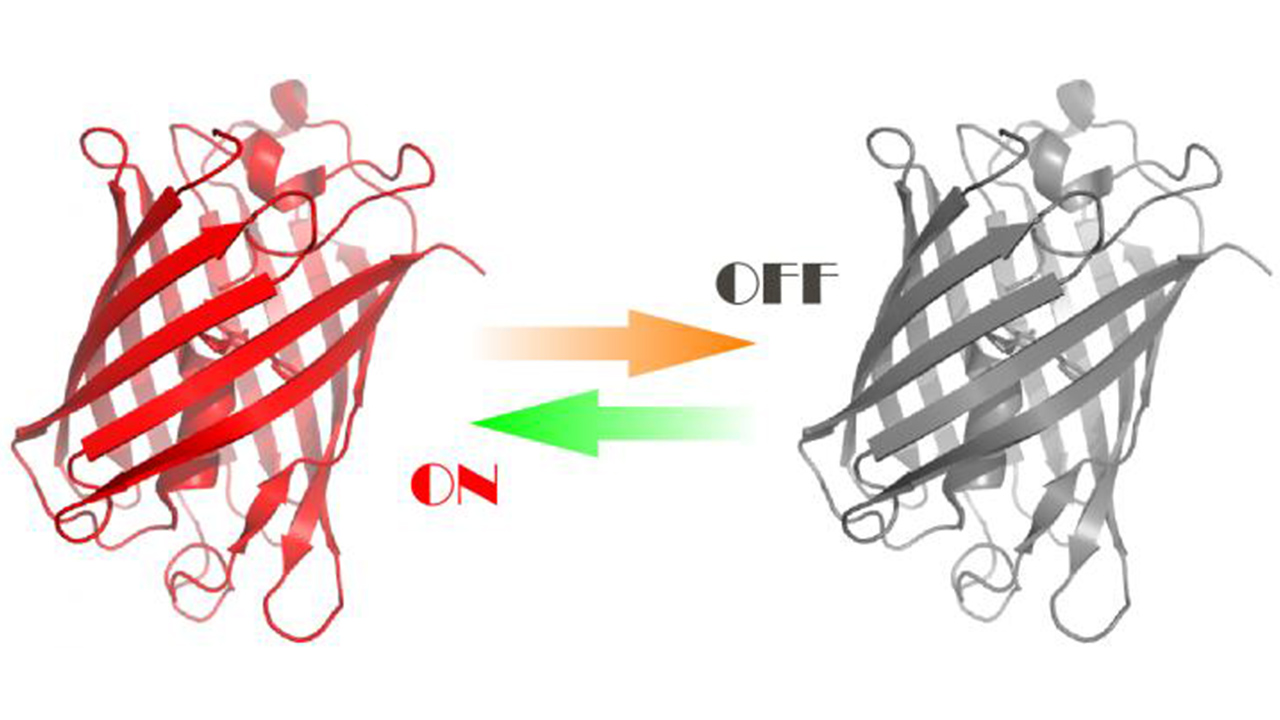
Las proteínas fluorescentes emiten una luz visible intensa con longitudes de onda comprendidas entre los 370 a los 700 nm. Las funciones naturales de estas proteínas son bastantes diversas, por ejemplo, alguna especie de medusas utilizan puntos verdes fluorescente para atraer a varios organismos pequeños que sirven de alimento. Las propiedades ópticas de ciertas proteínas fluorescentes se pueden controlar con luz, haciendo que estén “activadas” o “desactivadas”, por lo tanto, podemos decir que son conmutables. Estas proteínas fluorescentes conmutables se usan ampliamente en un nuevo grupo de métodos de investigación denominados como microscopía de fluorescencia de superresolución (nanoscopia), que permite obtener imágenes de estructuras intracelulares extremadamente detalladas. Los científicos suelen usar la irradiación azul o violeta para este tipo de microscopía, que es muy tóxica para las células, ya que altera su fisiología normal y puede incluso causar la muerte.
«Fuimos los primeros en crear proteínas fluorescentes intercambiables con propiedades ópticas que pueden controlarse con luz verde y naranja, en lugar de radiación violeta azul. La ventaja de esto es el daño mínimo a las células. Hemos utilizado estas nuevas proteínas para observar los cambios del citoesqueleto en células vívas a lo largo del tiempo «, explicó Aleksandr Mishin, Ph.D, investigador principal del Instituto de Química Bioorgánica Shemyakin-Ovchinnikov de la Academia de Ciencias de Rusia, quien dirigi el proyecto.
Para crear tales proteínas fluorescentes, los científicos las alteraron mediante una mutagénesis directa y aleatoria usando un método denominado “reacción en cadena de polimerasa”. Después, se clonaron las proteínas y seleccionaron las que tenían los mejores resultados utilizando el microscopio. Los autores analizaron los resultados de los experimentos llevados a cabo por otros biólogos y descubrieron cómo el microentorno del cromóforo (el residuo de aminoácido aromático responsable de la absorción de luz en la proteína) debe alterarse para que sea capaz de realizar el intercambio de fotones.
Sin embargo, el resultado esperado tiene sus efectos secundarios: por ejemplo, el brillo de la proteína se reduce. Ahora, los investigadores utilizan la mutagénesis aleatoria para encontrar mutaciones adicionales, que compensan los efectos secundarios y preservan la mutación objetivo.
Las proteínas desarrolladas se llaman proteínas informadoras, ya que actúan como «espías» dentro de las células. Se unen a otras proteínas, que luego se pueden rastrear en una célula viva. La información detallada obtenida de este modo se puede utilizar en ciencia básica o investigación biomédica. Por ejemplo, las células tumorales en pacientes con cáncer exhiben alteraciones dramáticas de la movilidad celular y cambios estructurales dinámicos en el citoesqueleto, una carcasa en el citoplasma de una célula viva. Mientras tanto, la investigación de estos procesos en células vivas mediante nanoscopia es difícil debido a la irradiación excesivamente intensa de las muestras, por lo que es necesario utilizar métodos que sean menos tóxicos para el organismo.
Los autores utilizaron su investigación para llevar a cabo la microscopía de súper resolución RESOLFT. Las proteínas tienen una característica importante: su intercambio de fotones es muy eficiente, lo que significa que la fluorescencia se puede activar y desactivar en milisegundos. Esto no es adecuado para todos los métodos de microscopía. En algunos casos, la alta velocidad solo será una molestia. En RESOLFT, el ciclo de encendido y apagado se repite muchas veces para los puntos adyacentes que se escanean con rayos láser. Cuanto mejor sea el tiempo de cambio de una etiqueta fluorescente, más rápida será la obtención de la imagen completa, ya que el intercambio de fotos en cada punto requiere menos tiempo.
«Las proteínas fluorescentes que creamos permitirán la microscopía de súper resolución sin dañar la célula viva, lo que abre oportunidades para estudiar procesos dinámicos dentro de la célula», concluyó Aleksandr Mishin.
Créditos Imagen: Aleksandr Mishin