Una nueva generación de dispositivos implantables promete cambiar radicalmente el modo en que administramos fármacos en el organismo. Científicos de varias instituciones internacionales han desarrollado el primer sistema inalámbrico capaz de activar medicamentos fotoactivables de forma remota en órganos específicos, sin necesidad de fibra óptica, con una precisión milimétrica y sin los efectos secundarios asociados a tratamientos sistémicos.
La investigación, publicada en la revista científica Biosensors and Bioelectronics, supone un hito en el campo de la fotofarmacología y abre la puerta a tratamientos más seguros y personalizados, especialmente en enfermedades crónicas como el dolor persistente, la epilepsia, el párkinson o incluso el cáncer.
El estudio ha sido liderado por Francisco Ciruela, profesor de la Facultad de Medicina y Ciencias de la Salud de la Universidad de Barcelona y miembro del Instituto de Neurociencias (UBneuro) y del Instituto de Investigación Biomédica de Bellvitge (IDIBELL), junto con los expertos John Rogers (Northwestern University), Amadeu Llebaria (IQAC-CSIC) y Jordi Hernando (Universitat Autònoma de Barcelona).

Qué es la fotofarmacología
La fotofarmacología es un campo emergente que combina química, biotecnología y fotónica para diseñar fármacos cuya actividad puede controlarse mediante la luz. Estos compuestos, denominados fotoactivables, permanecen inactivos en el organismo hasta que se exponen a una longitud de onda específica, momento en el que se activan y ejercen su efecto terapéutico.
Este enfoque ofrece una ventaja clave frente a la administración tradicional de medicamentos: permite actuar con altísima precisión espacial y temporal. En lugar de distribuir un principio activo por todo el cuerpo —con el consiguiente riesgo de toxicidad o efectos no deseados—, la fotofarmacología permite liberar el fármaco solo donde y cuando se necesita. Sin embargo, hasta ahora, la activación lumínica se realizaba mediante fibras ópticas insertadas en el cuerpo, lo que limitaba su aplicación clínica.
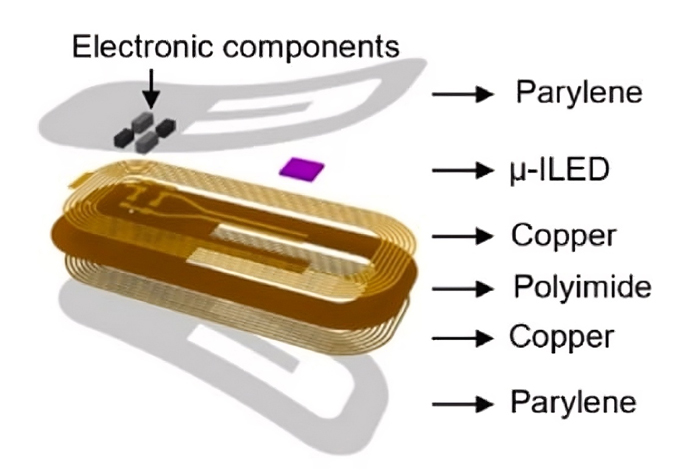
El nuevo desarrollo rompe esta barrera gracias a un sistema inalámbrico implantable que integra un microled y una antena de radiofrecuencia para activar el fármaco sin cables ni conexiones físicas.
Morfina fotoencapsulada para el tratamiento del dolor
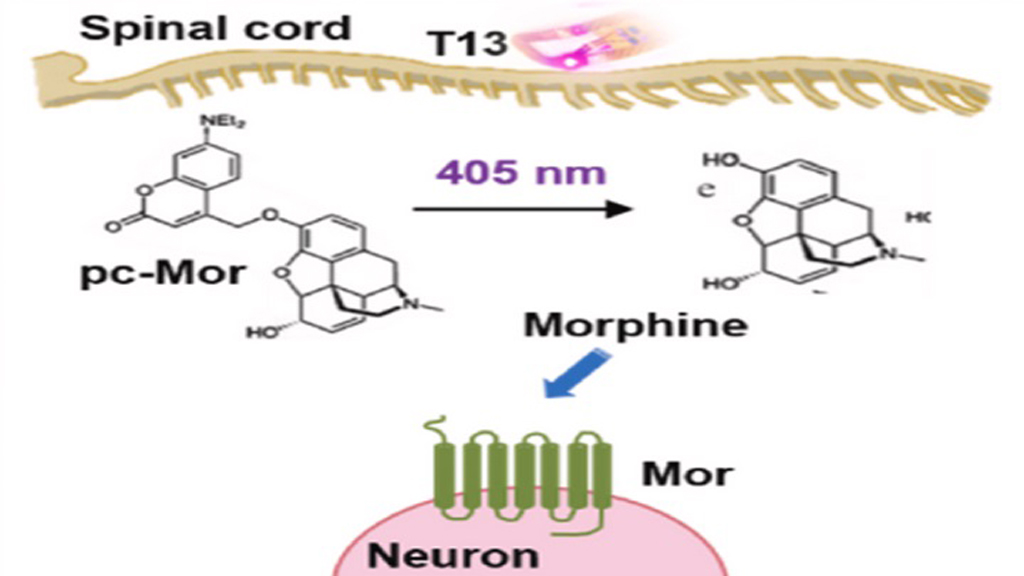
Para validar esta tecnología, el equipo de investigación eligió uno de los compuestos más representativos del tratamiento del dolor: la morfina. En concreto, utilizaron una versión modificada conocida como photo-caged morphine (pc-Mor), que incorpora un grupo químico fotosensible —una unidad de cumarina— que bloquea temporalmente la capacidad del opioide para unirse a sus receptores.
El funcionamiento es sencillo en concepto, aunque complejo en su ejecución. Una vez administrada la morfina fotoencapsulada en el organismo, esta permanece inactiva. Solo cuando se aplica luz de 405 nanómetros —en la región del violeta— sobre el tejido diana, se rompe el enlace fotosensible, liberando la morfina activa justo en ese punto. El resultado: analgesia localizada sin efectos secundarios sistémicos.
La tecnología que lo hace posible es un dispositivo miniaturizado, del tamaño de unos pocos milímetros, que se implanta en el tejido objetivo (en este caso, la médula espinal) de modelos animales. Este microimplante integra:
- Un microled que emite luz en la longitud de onda adecuada.
- Una antena de radiofrecuencia que recibe energía de forma inalámbrica mediante tecnología NFC (como la que usan los pagos por contacto).
- Un sistema de control que permite modular la intensidad y frecuencia de la luz emitida.
La ventaja fundamental del sistema es que permite al animal —y en un futuro, al paciente— moverse libremente sin estar conectado a una fuente externa. Esto elimina las interferencias que pueden alterar los resultados experimentales o la eficacia terapéutica. Además, el control remoto del dispositivo permite programar cuándo y con qué intensidad se activa el microled, adaptando el tratamiento a las necesidades clínicas.
Resultados: igual de eficaz que la morfina tradicional, pero sin efectos secundarios
Los resultados obtenidos en modelos animales muestran que la liberación localizada de morfina mediante este sistema produce un efecto analgésico comparable al de la morfina administrada por vía sistémica. Sin embargo, a diferencia de esta última, el método fotofarmacológico no provoca efectos secundarios típicos de los opioides como:
“La diferencia sobresaliente fue la ausencia de los efectos adversos típicos de los opioides, como la tolerancia al efecto analgésico, el estreñimiento, la dependencia y la adicción. Superar la posible dependencia y los efectos secundarios asociados con los opioides fue una de las principales motivaciones”, explica Francisco Ciruela.
Este es uno de los aspectos más prometedores de la investigación, ya que podría transformar el abordaje clínico del dolor crónico, reduciendo la necesidad de tratamientos continuos con opioides y sus consecuencias sociales y sanitarias.
Aplicaciones más allá del dolor
Más allá del tratamiento del dolor, el nuevo protocolo de fotofarmacología inalámbrica —basado en la activación lumínica y la liberación localizada y controlada de fármacos— ofrece un amplio potencial terapéutico para diversas patologías.
Uno de los ámbitos más prometedores es el tratamiento personalizado de enfermedades crónicas. “En el caso de la epilepsia, la liberación local de fármacos anticonvulsivos en regiones cerebrales específicas podría permitir el control de las crisis sin afectar al resto del sistema nervioso central, evitando así la sedación y otros efectos secundarios generalizados”, detalla Ciruela.
En enfermedades neurodegenerativas como el párkinson, la activación localizada de agentes dopaminérgicos o de otros moduladores neuronales podría contribuir a una mejora focalizada de los síntomas motores, incrementando la eficacia terapéutica y reduciendo riesgos. Asimismo, en trastornos psiquiátricos como la esquizofrenia, la activación selectiva de antipsicóticos en áreas concretas del cerebro podría potenciar los efectos beneficiosos del tratamiento, minimizar los efectos secundarios y favorecer una mayor adherencia del paciente.
El potencial de esta tecnología también se extiende al ámbito oncológico. La fotoactivación de quimioterapéuticos directamente en el entorno tumoral emerge como una estrategia viable para alcanzar concentraciones elevadas del fármaco en el tejido objetivo, reduciendo al mismo tiempo la toxicidad sistémica que suele limitar la eficacia de los tratamientos convencionales.
No obstante, la traslación clínica de esta innovación conlleva importantes retos. Desde el punto de vista farmacológico, será necesario evaluar rigurosamente la biodisponibilidad, la estabilidad química y la seguridad de los productos derivados del proceso de fotólisis. En el plano tecnológico, el diseño y validación de dispositivos implantables plantea desafíos en términos de biocompatibilidad, durabilidad estructural, miniaturización, gestión energética e integración funcional en el organismo.
A ello se suma una dimensión normativa igualmente compleja. “Desde una perspectiva reguladora, esta tecnología requerirá marcos específicos para productos combinados, al integrar en un solo sistema un fármaco y un dispositivo médico, lo cual complica los procedimientos de aprobación y la supervisión clínica”, concluye Ciruela.

Créditos de imágenes: Universidad de Barcelona


